1. Mối liên hệ giữa động học tinh trùng và chất lượng phôi
Trong hỗ trợ sinh sản (HTSS), sự thành công của một chu kỳ phụ thuộc mật thiết vào tính toàn vẹn của nhiễm sắc thể (NST) phôi. Sàng lọc di truyền tiền làm tổ (PGT-A) cho phép đánh giá karyotype của tế bào lá nuôi phôi (TE) để sàng lọc các tình trạng lệch bội và thể khảm [1]. Các dữ liệu lâm sàng gần đây nhấn mạnh rằng, bên cạnh yếu tố tuổi mẹ, chất lượng di truyền của tinh trùng—đặc biệt là chỉ số phân mảnh DNA (DFI)—là biến số then chốt ảnh hưởng đến tỷ lệ phôi nguyên bội [2]. Thời gian kiêng xuất tinh (EA) là yếu tố lâm sàng có thể can thiệp nhằm tối ưu hóa các thông số này.
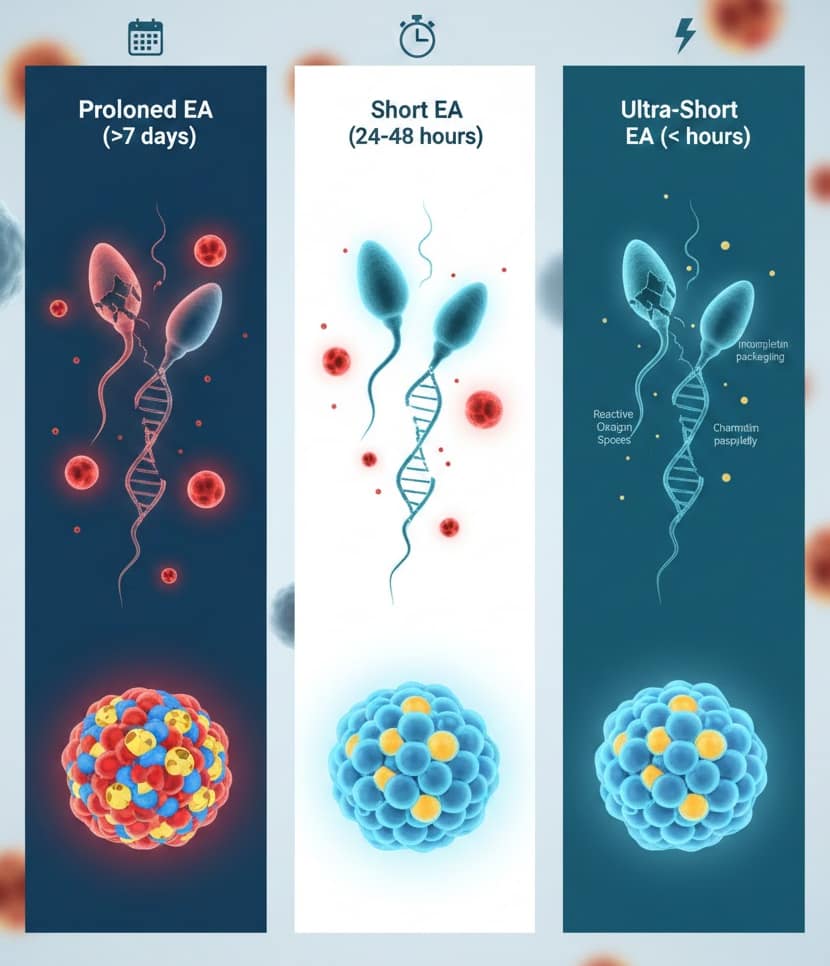
2. Cơ chế bệnh sinh của tổn thương DNA do kiêng xuất tinh kéo dài
Sự thay đổi thời gian EA gây ra những biến đổi rõ rệt trong tinh dịch đồ. Theo WHO và ESHRE, khoảng thời gian tiêu chuẩn thường dao động từ 2–7 ngày [3]. Tuy nhiên, về mặt sinh học phân tử, việc kéo dài EA dẫn đến sự tích tụ tinh trùng tại đuôi mào tinh—nơi chúng phải chịu áp lực từ các gốc oxy tự do (ROS).
Do tinh trùng đã ngưng quá trình phiên mã và dịch mã, chúng thiếu hụt các cơ chế tự sửa chữa DNA nội bào [4]. Sự tiếp xúc kéo dài với stress oxy hóa dẫn đến các đứt gãy sợi đơn và sợi đôi. Ngược lại, phác đồ EA ngắn (< 48 giờ) hoặc “cực ngắn” (1–4 giờ) giúp huy động nhanh chóng quần thể tinh trùng mới từ ống dẫn tinh, giảm thiểu thời gian lưu kho tại mào tinh, từ đó hạ thấp DFI xuống mức tối thiểu [5]. Mặc dù EA cực ngắn có thể tiềm ẩn nguy cơ về lỗi đóng gói chromatin do thiếu hụt protamine, nhưng lợi ích từ việc giảm tổn thương DNA do ROS thường vượt trội hơn trong việc cải thiện chất lượng di truyền phôi [6].
3. Tương tác giao tử và hệ quả di truyền sau hợp tử
Hệ quả của DFI cao không chỉ dừng lại ở giai đoạn thụ tinh mà còn kéo dài đến quá trình phân bào của phôi. Noãn có khả năng sửa chữa các tổn thương DNA tinh trùng sau thụ tinh, nhưng khả năng này bị giới hạn bởi “ngưỡng sửa chữa” và suy giảm tuyến tính theo tuổi mẹ [7].
Khi DFI vượt ngưỡng hoặc khả năng sửa chữa của noãn bị lão hóa, phôi dễ phát sinh các lỗi nguyên phân (mitotic errors). Điều này dẫn đến tình trạng bất ổn định NST sớm, hình thành các dòng tế bào khác nhau trong cùng một phôi (thể khảm) hoặc khiến phôi ngừng phát triển hoàn toàn [8]. Các nghiên cứu PGT-A cho thấy tỷ lệ phôi nguyên bội giảm đáng kể ở nhóm nam giới có DFI cao so với nhóm DFI thấp (29,7% so với 41,3%) [9]. Ở nhóm vô sinh nam nặng, tỷ lệ phôi khảm cũng được ghi nhận cao hơn rõ rệt (7,7% so với 0,5% ở nhóm chứng) [10].
4. Kết luận
Thời gian kiêng xuất tinh là một yếu tố can thiệp lâm sàng có ý nghĩa chiến lược. Việc cá thể hóa phác đồ EA, đặc biệt là ưu tiên EA ngắn cho các cặp vợ chồng có DFI cao hoặc tuổi mẹ cao, là giải pháp hiệu quả nhằm giảm thiểu rủi ro thể khảm và nâng cao tỷ lệ phôi nguyên bội trong HTSS.
Tài liệu tham khảo
- Homer HA. Preimplantation genetic testing for aneuploidy (PGT-A): The biology, the technology and the clinical outcomes. J Obstet Gynaecol. 2019;59(2):317-24.
- Cascales A, et al. Factors associated with embryo mosaicism: a systematic review and meta-analysis. J Assist Reprod Genet. 2023;40(10):2317-24.
- Russo G, et al. Ejaculatory abstinence duration impacts semen parameters: Insights from a retrospective analysis. Front Endocrinol. 2025;16:1529262.
- González-Marín C, et al. Types, causes, detection and repair of DNA fragmentation in sperm cells. Int J Mol Sci. 2012;13(11):14026-52.
- Raditya AM, et al. Impact of shorter abstinence periods on semen parameters. World J Mens Health. 2024;43(3):563.
- Deng A, et al. The impact of culture conditions on blastocyst formation and aneuploidy rates. J Assist Reprod Genet. 2020;37(1):161-9.
- Karabulut S, et al. Impact of Maternal Age on the Repairing Capacity of Oocytes. Reprod Sci. 2025:1-7.
- Li P, et al. Perspective in the mechanisms for repairing sperm DNA damage. Reprod Sci. 2025;32(1):41-51.
- Wan S, et al. Effect of sperm DNA fragmentation on embryo euploidy rate: a meta-analysis. Eur J Med Res. 2025;30(1):1138.
- Tarozzi N, et al. Male factor infertility impacts the rate of mosaic blastocysts in PGT-A cycles. J Assist Reprod Genet. 2019;36(10):2047-55.



